IMPLICATION D’UN FACTEUR D’ELONGATION DE LA TRADUCTION DANS LA REGULATION REDOX
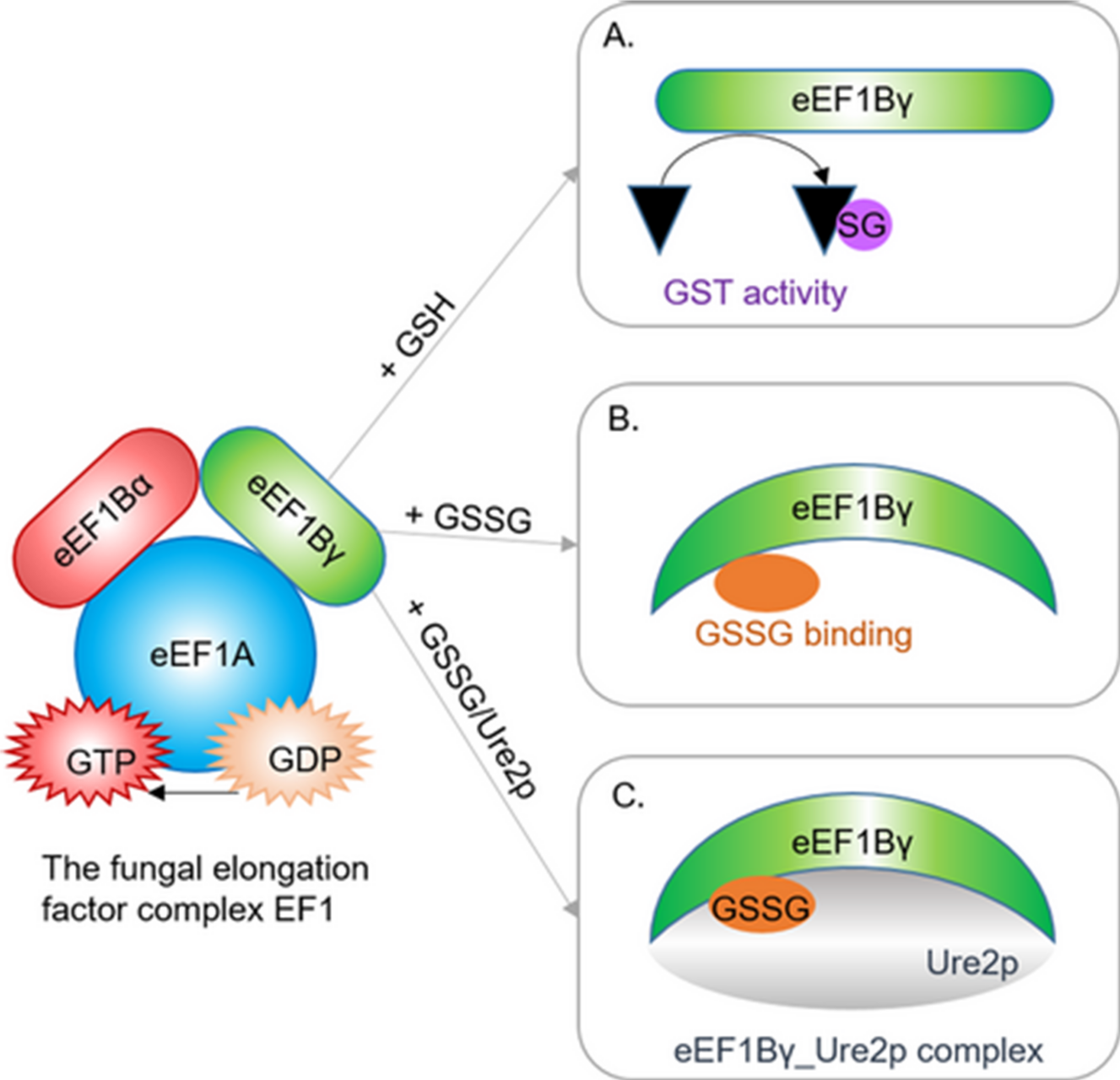
Chez le champignon Phanerochaete chrysosporium, la sous-unité eEF1Bγ du facteur d’élongation EF1 est connue pour agir comme une protéine d’échafaudage stabilisant le complexe EF1. Grâce notamment à des approches thermodynamiques (ITC) et cinétiques (switchSENSE) réalisées sur la plateforme ASIA, des chercheurs de l’UMR IAM ont montré que la sous-unité possède des caractéristiques supplémentaires : Elle est active comme glutathion transférase en présence de glutathion réduit (A), elle change de conformation lors de la liaison du glutathion oxydé (B), et le glutathion oxydé favorise l’interaction entre eEF1Bγ et la glutathion transférase Ure2p (C), suggérant une régulation redox présumée du facteur d’élongation.
Les résultats viennent de faire l’objet d’une publication dans The FEBS Journal [Bchini R., Girardet J.M., Sormani R., Gelhaye E. & Morel-Rouhier M. (2020). Oxidized glutathione promotes association between Eukaryotic Translation Elongation Factor 1Bγ and Ure2p glutathione transferase from Phanerochaete chrysosporium. https://doi.org/10.1111/febs.15614].